ציפוי זהב, מעגלים אלקטרוניים, גימור כרום? בואו נעשה את זה בפועל.
הקמת המערכת
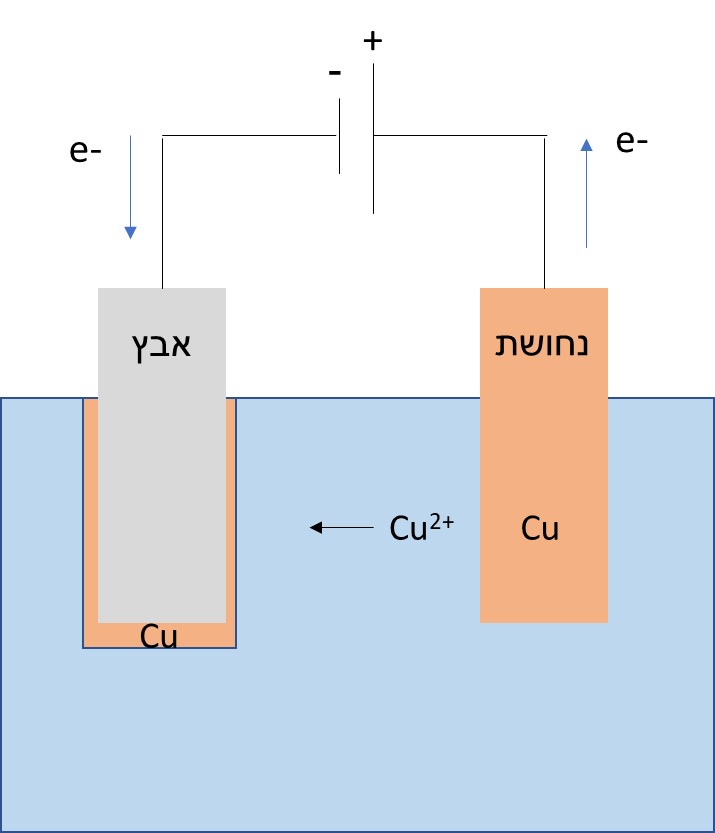
אנחנו בונים כאן מעגל חשמלי כאשר מתכת אחת מחוברת לקוטב החיובי של הסוללה והשנייה לשלילי.
ראשית הכניסו מים לכוס והציבו את מוט הנחושת ומטבע של 10 אגורות או מוט אבץ בתוך הכוס כך שלא יגעו זה בזה.
בעזרת חוטי חשמל חברו בין הסוללה למוט\מטבע המתכת (אם יש לכם קיט מעגל חשמלי יש לכם בית סוללה ותנינים אבל אפשר פשוט להחזיק את הכל ע"י ליפוף החוטים או נייר דבק).
מה התוצאה? - לא קורה כלום.
עכשיו נתקו את החשמל והוסיפו כפית מלח לכוס וקצת חומץ.
החזירו את החשמל.
מה קורה עכשיו?
הסבר קצר
הסוללה מספקת אלקטרונים, המלח והחומץ מספקים יונים (מולקולות\אטומים) בעלי מטען חשמלי שלילי או חיובי. כאשר יש יונים בתמיסה הם יכולים לנוע בהתאם למטען החשמלי וכך לאפשר זרם חשמלי.
בתא אלקטרוליטי שדרכו מזרימים זרם חשמלי על מנת לבצע אלקטרוליזה האנודה היא האלקטרודה החיובית ואילו הקתודה היא האלקטרודה השלילית. הסוללה מספקת אלקטרונים אותם מקבלים היונים החיוביים.
לדוגמא, אטומי מימן שמגיעים מהחומץ. בצורה זו אטומים אלה הופכים לגז מימן ואנו רואים בועות באזור הקטודה - מוט המתכת שמחובר לצד השלילי של הסוללה.
מה קורה בתמיסה שלנו? האנודה (במקרה זה חיובית) מוסרת אלקטרונים ולכן המתכת שבה הופכת ליונים חיוביים. בתמיסה שלנו יש הרבה יונים שליליים ואלו מושכים אליהם אטומים חיוביים מהאנודה, יונים אלה נודדים אל הקתודה (מוט המתכת שמחובר לצד השלילי של הסוללה) שם הם מקבלים אלקטרונים וחוזרים להיות מתכת.
בדרך זו, אם חיברנו את מוט הנחושת לצד החיובי של הסוללה, הפכנו אותו לאנודה (ספק אלקטרונים) ואטומי הנחושת יהגרו ויצפו את מוט האבץ\מטבע (קטודה). שימו לב, מי קטודה ומי אנודה זה די מבלבל אז פשוט נומר שהאנודה נותנת אלקטרונים והקטודה מקבלת אותם. לכן, במיקרה שלנו המטען של האנודה חיובי (היא נתנה אלקטרונים לסוללה).
ציפוי מתכת
אז בעצם בשביל לצפות מתכת או כל חומר מוליך אחר צריך זרם חשמלי ופיסת מתכת שתיתן את האלקטרונים (תשמש כאנודה) ותצפה את המתכת השניה.
לעיניינו, שנו את כיוון הסוללה ותראו כי פעם האבץ הכסוף מצפה את הנחושת ופעם הנחושת החומה מצפה אתה אבץ.
בדומה לכך, ניתן לקחת תכשיט עשוי פליז (סגסוגת זולה) ולצפות אותו בזהב. כאשר אנו רואים ציפוי של 14 קרט מדובר על אלקטרודה של 14 קרט זהב.